ロタウイルス(rotavirus)は、乳幼児における下痢症の主要な病原体である。レオウイルス科に属する二本鎖RNAウイルスの属である。離島国などを除き世界中でほとんどの乳幼児が5 - 6歳までに一度はロタウイルスの感染を経験する。感染のたびに免疫が誘導されるため、回を追うごとに軽症化し、大人は発症しないか、極めて軽微となる。
ロタウイルスは糞口経路によって伝播する。ロタウイルスが感染すると小腸に並ぶ細胞は障害を受け、胃腸炎を引き起こす。1973年にはRuth Bishopらによって発見されて電子顕微鏡像が得られていたが、歴史的にこのウイルスの重要性は公衆衛生上軽視されてきており、その傾向は発展途上国で特に顕著である。ヒトの医療において重要のみならず、動物にも感染するこのウイルスは家畜の病原体でもある。
通常、ロタウイルス感染症は管理の容易な小児疾患であるが、一方で、2013年の1年間でロタウイルスは小児の全下痢症による死亡の37%を占めて、21万5千人の乳幼児の死亡を引き起こしていると見積もられ、さらに死亡者以外にも200万人が重症化するとされる。死亡例や重症症例のほとんどは、発展途上国で発生する。
アメリカ合衆国では、ロタウイルスワクチンの接種プログラムを開始する前で、270万人の子供が胃腸炎を発症し、6万人が医療介入を受け、37人前後が死亡していた。ロタウイルスワクチンの導入に伴い、アメリカ合衆国では医療介入を受ける患者の割合が激減している。
ロタウイルスの制圧に向けた公衆衛生キャンペーンは、感染者への経口補水と予防のためのワクチン接種に焦点を当てている。ロタウイルスワクチンを小児期の予防接種プログラムに導入した国家では、ロタウイルスの発生と重症化が減少している。
ウイルス学
ロタウイルスの型
ロタウイルスはAからH群までの8つの種に分かれる。ヒトは主にA群、B群、C群に感染し、特にA群への感染が多い。E群やH群はブタに、D群、E群、F群は鳥類に感染する。A群ロタウイルスはさらに複数の株に分かれ、これを血清型と呼ぶ。血清型はインフルエンザウイルスと同様に2つの表面タンパク質の組み合わせによって命名される。糖タンパク質VP7がG血清型を、プロテアーゼ感受性タンパク質VP4がP血清型を決定する。G型を定義する遺伝子とP型を定義する遺伝子は別々に子孫ウイルスへ継がれるため、様々な組み合わせが生じる。A群ロタウイルスの型の決定には、非定型的なロタウイルスの遺伝子型を決定するために、全ゲノム遺伝子型別 (whole genome genotyping) が用いられることもある。また、ロタウイルスの型の分布は年と地域によって変動する。
ウイルスのタイピングができるようになって、C群ロタウイルスの流行はA群ロタウイルスに比べると遅いことがわかってきており、C群発症例115例の解析では、5~9歳が57%、10~14歳が20%を占めていた。
構造
ロタウイルスのゲノムは11分節に分かれる計18,555塩基対の二本鎖RNAである。各分節は1つの遺伝子であり、大きいものから順に1から11の番号が割り当てられている。各遺伝子は1種類のタンパク質をコードしているが、第9遺伝子分節は例外的に2つのタンパク質をコードする。RNAは外殻、内殻からなる2層のカプシドと、その内層に存在するコアの合わせて3層からなるタンパク質に包まれ、コアを包むカプシドタンパク質の形状は正二十面体である。ウイルス粒子の粒子径は最大で76.4 nmであり、エンベロープを持たない。
タンパク質
6つのウイルスタンパク質 (VP) がウイルスの粒子を構成する。この構造タンパク質群はそれぞれVP1、VP2、VP3、VP4、VP6およびVP7と呼ばれる。糖タンパク質VP7がG血清型を決定する。構造タンパク質であるVPに加え、ロタウイルスは感染細胞の細胞内ではさらに非構造タンパク質 (NSP) を合成する。この非構造タンパク質はそれぞれNSP1、NSP2、NSP3、NSP4、NSP6およびNSP7と呼ばれる。
ロタウイルスゲノムにコードされる12の遺伝子のうち、6つはRNA結合性タンパク質である。ロタウイルスの複製におけるこれらのタンパク質の役割は完全には理解されていないが、RNAの合成とウイルス粒子へのパッケージング、ゲノム複製の場へのmRNA輸送、mRNAの翻訳と遺伝子発現調節に関与すると考えられている。
構造タンパク質
VP1はウイルス粒子のコア内に存在するRNAポリメラーゼである。感染細胞内でVP1はウイルスタンパク質の合成や新しく合成されたウイルス粒子のゲノムとなるRNA分節の複製に用いられるmRNAを合成する。
VP2はウイルス粒子のコアを形成し、RNAと結合する。
VP3はコアの成分の1つで、グアニリルトランスフェラーゼと呼ばれる酵素である。VP3はキャップ形成酵素であり、mRNAの転写後修飾として生じる5'キャップの付加反応を触媒する。キャップ構造は核酸を分解する酵素であるヌクレアーゼからウイルスmRNAを保護することで、mRNAの安定化に寄与する。
VP4はスパイク状の突起としてウイルス粒子の表面に存在する外殻タンパク質である。VP4は細胞表面の受容体と呼ばれる分子に結合し、ウイルスの細胞への侵入を引き起こす。VP4は腸管に発現しているプロテアーゼであるトリプシンによって処理を受け、VP5*とVP8*に開裂する。VP4はウイルスの病原性を決定する因子であり、またロタウイルスのP型を決定する因子でもある。人の場合、ノロウイルスと同様に、血液型抗原の分泌の有無とロタウイルスに対する感受性は相関関係にある。血液型抗原を分泌しない人はP[4]型とP[8]型に抵抗性である様で、このことは前述の2つの遺伝子型のロタウイルスが血液型抗原を受容体として利用することを示唆する。
VP6はカプシドの主成分で内殻を構成する。抗原性が高く、ロタウイルスの種の同定に用いられる。また、VP6はA群ロタウイルス感染における検査に使用される。
VP7はウイルス粒子の外殻を形成する糖タンパク質である。構造に関わる他、VP7はG型を決定し、VP4と共にロタウイルス感染に対する免疫に関係する。
非構造タンパク質
NSP1は第5分節に由来する遺伝子産物で、非構造性のRNA結合タンパク質である。また、NSP1はインターフェロンに誘導される応答を阻害し、ウイルスの感染から細胞を守る自然免疫系の反応を抑える。NSP1は、感染細胞におけるインターフェロン産生の増強と、隣接細胞によって分泌されたインターフェロンに対する応答に必要な重要なシグナル分子を、プロテオソームによって分解してしまう。分解の標的となる分子としては、インターフェロン遺伝子の転写に必要なIRF転写因子などがある。
NSP2は細胞質内封入体に蓄積するRNA結合タンパク質で、ゲノム複製に必要な分子である。
NSP3は感染細胞内でウイルスmRNAに結合しており、細胞のタンパク質合成を遮断する役割を持つ。NSP3は宿主のmRNAからタンパク質を合成するために必要な2つの翻訳開始因子を不活化する。NSP3はまず、翻訳開始因子eIF4FからポリA結合タンパク質 (PABP) を外してしまう。PABPは3' ポリA尾部を持つ転写産物からの効率的な翻訳に必要な因子で、宿主細胞の転写産物のほとんどに結合している。次にNSP3はeIF2のリン酸化を促進することで、これを不活化する。ロタウイルスのmRNAはポリA尾部を欠いており、上記の2つの因子のいずれも翻訳に必要ではない。
NSP4は下痢を引き起こすウイルス性のエンテロトキシンで、ウイルス性のエンテロトキシンとしては初めて発見されたものである。
NSP5はA群ロタウイルスの第11分節にコードされる。感染細胞においてNSP5はヴィロプラズムに蓄積している。
NSP6は核酸結合タンパク質で第11分節にコードされており、位相の異なる (out-of-phase) オープンリーディングフレームから転写される。
この表はサルロタウイルスSA11株を許にしている。RNAとタンパク質の割り当ては一部の株で異なる。
複製
ロタウイルスの複製は主に腸で行われ、小腸の腸細胞の絨毛に感染、上皮に構造的、機能的変化をもたらす。三重のタンパク質の被膜により胃の酸性環境や腸管の消化酵素に耐えることができる。
ロタウイルスは細胞へ受容体性エンドサイトーシスによって侵入、エンドソームと呼ばれる小胞を形成する。最外層のタンパク質(VP7とVP4)はエンドソームの膜を破壊し、カルシウム濃度に変化をさせる。これがVP7三量体の崩壊を起こし、VP2とVP6によってなるdsRNAを包む殻を露出させた二重膜粒子の形成につながる。
11の二本鎖RNA分節が2層のタンパク質の殻に囲まれたまま、ウイルス性のRNA依存性RNAポリメラーゼによってウイルスのゲノムからmRNAが転写される。コアによって囲まれているため、ウイルスのRNAは、二本鎖RNAによって活性化する自然免疫反応であるRNA干渉を回避することができる。
感染時にロタウイルスはタンパク質の合成およびゲノム複製の両者のためにmRNAの合成を行う。ロタウイルスのタンパク質のほとんどはヴィロプラズムに集積し、RNAの複製と二重膜粒子の組み立てがこの場で行われる。ウイルスの二本鎖RNAゲノムの複製の鋳型となるプラス鎖RNAはヴィロプラズムの中にあり、siRNAによって誘導されるRNA分解を受けない。ヴィロプラズムは核の周縁に感染後2時間で形成され始め、2つの非構造タンパク質、NSP5とNSP2によって構成されると考えられているウイルス工場である。RNA干渉によってNSP5を阻害するとロタウイルスの複製効率は急激に低下する。二重膜粒子は小胞体へ輸送され、VP7とVP4によって構成される3番目の殻、外膜を獲得する。娘ウイルスは細胞溶解を伴って放出される。
感染経路
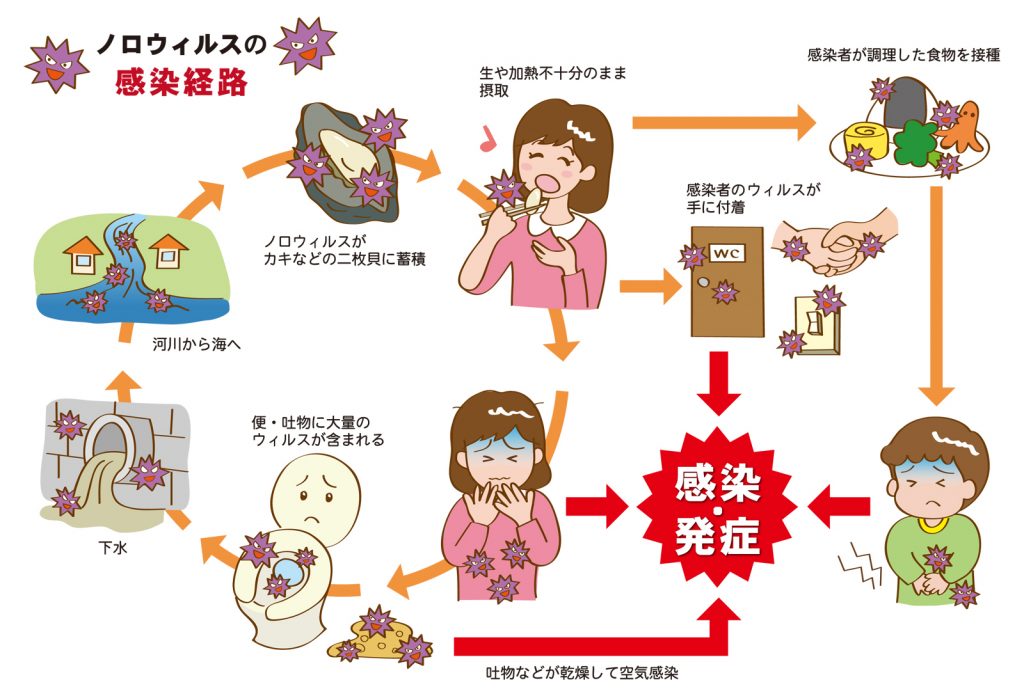
ロタウイルスは汚染された手や物との接触を通じて糞口経路によって伝播するが、さらに空気感染の可能性もある。ウイルス性の下痢は感染性が非常に高い。感染者の糞便は1グラムあたりで最大10兆以上のウイルス粒子を含み、100以下のウイルス粒子でも感染が成立する。
ロタウイルスは環境中でも安定である。細菌や寄生虫の除去に十分なほど衛生状態が良好でもロタウイルスの感染を抑えるには不十分なようであり、衛生状態の高い国と低い国でもロタウイルス感染症の罹患率はほとんど等しい。
徴候と症状
ロタウイルス性腸炎は軽度から重度の至る疾患で、吐き気、嘔吐、水様性の下痢、軽い発熱を特徴とする。幼児がロタウイルスに感染した場合、症状が現れるまでの潜伏期 (incubation period) は約2日程度である。腸炎は急性経過をとり、発症後しばしば最初に嘔吐が認められ、その後4日から8日程度の重篤な下痢が続く。脱水症状が他の細菌性下痢症に比べ発生しやすく、これはロタウイルス感染症の主要な死因でもある。ロタウイルスによる胃腸炎は、ノロウイルスやアデノウイルスなどによる胃腸炎より重症化しやすい傾向がみられる。
A群ロタウイルスの感染は生涯を通じて起こりうるが、初感染時に通常認められる症状は、2回目以降では軽微、あるいは不顕性である。2回目以降の感染時の症状の減弱は免疫系による防御に由来する。そのため顕性感染は2歳以下の乳幼児で多く、45歳まで年齢を重ねるにつれて減少する。新生児の感染はよくみられるが、軽微か不顕性である事が比較的多く、最も重症化しやすいのは6ヶ月から10歳の乳幼児・小児や高齢者、あるいは免疫不全症患者である。幼少期に獲得する免疫により、ほとんどの成人はロタウイルスに抵抗性である。成人の胃腸炎は通常他の病原体によるが、一方で成人の不顕性感染が集団における感染経路の維持に寄与している可能性がある。また、血液型抗原の分泌状態と腸内細菌叢の構成はロタウイルス感染の感受性に影響を及ぼすかもしれないと指摘されている。
発病機構
ロタウイルスは主に腸で増殖し、小腸の絨毛における腸細胞に感染、上皮の構造的、機能的変化をもたらす。動物実験によってロタウイルスが腸管外に拡がって他の臓器やマクロファージに感染することが示されており、これはヒトでも同様と考えられる。
下痢はウイルスの活動によって発生する。吸収不良は腸細胞(小腸吸収上皮細胞とも)と呼ばれる腸管の細胞の破壊による。ロタウイルスの産生するタンパク質、NSP4はエンテロトキシンであり、このタンパク質は年齢やカルシウムイオン依存的に塩化物イオンの分泌を促進、ナトリウム-グルコース共輸送タンパク質による水の再吸収を阻害、刷子縁のジサッカリダーゼを阻害する効果を持ち、さらに腸神経系のカルシウム依存性分泌反射を活性化する可能性がある。腸細胞は小腸にラクターゼを分泌する役割を持ち、ラクターゼの喪失による牛乳不耐性はロタウイルス感染の症状の1つであるが、この症状は数週間に渡って継続する事がある。牛乳をしばらく子どもの食事から除いた後、再び食事に加えるとしばしば軽度の下痢が再発する。これは腸管の細菌による二糖(ラクトース)の発酵が原因である。
診断と検出
ロタウイルスの感染を診断するには通常重篤な下痢の原因となる胃腸炎の診断に続く。小児が胃腸炎によって病院で診察を受ける場合はほとんどの場合A群ロタウイルスの検査が行われる。A群ロタウイルスの特異的診断は小児の便を試料としたELISA法によるウイルスの検出によってなされる。感度、特異性が高い、A群ロタウイルスの全血清型を検出できる認可済みの診断キットは複数の製品が市場に流通している。他の検出法としては、電子顕微鏡によるウイルス粒子の確認や、PCRによる検出が研究目的の実験室で用いられる。また、逆転写PCR (RT-PCR) 法を用いる事でヒトのロタウイルスの全ての種の全ての血清型を診断、同定できる。
治療と予後
ロタウイルスの急性感染における治療は、非特異的な対症療法であり、脱水対策が最も重要となる。無治療の場合、小児は重度の脱水を起こすと、死亡に至る事もある。下痢の重篤度に応じて経口補液を行い、補液時においては少量の塩分と糖分を含む十分な量の水を飲ませる。
2004年にはWHOとUNICEFが、急性下痢の治療用に低浸透圧の経口補水液と亜鉛サプリメントの併用を推奨している。感染した小児のおよそ50%が受診、そのうち約10%が脱水を理由に入院が必要となり、点滴や経鼻胃管による補液、電解質や血糖値のモニタリングが行われる。
また、プロバイオティクスはロタウイルスによる下痢の持続期間を減少させることが示されており、ヨーロッパ小児消化器病学会は「効果的な介入としてラクトバチルス・ラムノサスやサッカロマイセス・ブラウディなどのプロバイオティクス、ジオスメクタイト、ラセカドトリルの投与がある」としている。
ロタウイルスが他の合併症を招く事は稀であり、先進国では適切に治療されれば、小児の予後は良好であるが、開発途上国では、年間数十万人がロタウイルス感染による下痢症で死亡し、また、腸重積、肝炎、胆道閉鎖症、1型糖尿病、腎後性腎不全、脳炎、髄膜炎、脳症など、さまざまな病態との関連が疑われる事もある。
予防
ロタウイルスは感染性が強く、また抗生物質やその他の治療薬は効果がない。衛生状態の改善ではロタウイルス感染症の蔓延を防ぐことができず、一方で経口補水を行なってもなお入院率が高いため、ロタウイルスへの主な医療介入には予防接種が行われる。世界的に認可されているA群ロタウイルスに対してのワクチンとして、ロタリックス(Rotarix; グラクソ・スミスクライン)およびロタテック (RotaTeq; MSD) が存在し、いずれも小児に対して安全で効果的である。重症ロタウイルス下痢症乳児の大幅な減少成果を認め、共にコクランのレビューで発症阻止能が認められている。1990年代に使用されていたワクチン (RotaShield) の副反応として腸重積が多発したことが報告されていたが、2006年頃以降市場に出ているワクチンと腸重積との関連性は認められていない。いずれも経口ワクチンで弱毒生ウイルスを含む。2014年にインドで認可されたROTAVAC、2007年にベトナムで認可されたMotavin-M1、2000年に中国で認可されたLanzhou Lambの3つは特定の国の市場においてのみ認可されている。2017年時点、2つの有効なワクチンの保存は冷蔵できる環境が必要である。このことは、コストが大きくなるとともに接種可能な場所や対象は制約を受ける。このため、新たなワクチンの開発も試みられている。また、他にも複数のロタウイルスワクチンが開発中である。
2009年に世界保健機構(WHO)は各国における予防接種プログラムへのロタウイルスワクチン導入を推奨した。この推奨策を実施した国ではロタウイルス感染症の発生率と重症度が明らかに減衰している。予防接種プログラムにロタウイルスワクチンを導入した国において行われた臨床治験のデータをまとめた2014年のレビューはロタウイルスワクチンがロタウイルスに起因する入院を49-92%減少させ、さらに全下痢症の入院患者数を17-55%減少させることを明らかにした。2006年にロタウイルスワクチンを世界で初めて導入した国の1つであるメキシコでは、ロタウイルス性の下痢症による2歳以下の死亡率が2009年のシーズンには65%以上減少した。ニカラグアは2006年に発展途上国として初めてロタウイルスワクチンを導入し、ロタウイルスの感染を40%まで減少させ、救急救命室の利用を半減させた。アメリカ合衆国ではロタウイルスワクチンの接種が2006年に開始され、ロタウイルスの検出数が86%低下している。ワクチンは市中の感染数を減少させることで、免疫を受けていない小児の疾患をも予防するかもしれない。ロタウイルスによる死はほとんどがアフリカやアジアの発展途上国で発生するが、これらの国々ではRotarixとRotaTeqに関する多数の臨床試験が行われた他、近年はワクチン導入後の影響を評価する調査が実施され、ワクチンの導入によって乳児の重症例が劇的に減少することが示された。2013年にはイギリスで2-3ヶ月の全ての乳児に対しワクチンが提供された。これはロタウイルス感染の重症例を半減させ、入院例を70%減少させることを期待して行われている。ヨーロッパではワクチンの導入によってロタウイルス感染による入院例が65%から84%減少した。ロタウイルスワクチンは100カ国以上の国で認可されており、さらに80カ国以上の国が予防接種プログラムに組み入れている。また、そのうちおよそ半数の国はGAVIアライアンスによる援助を受けている。ロタウイルスワクチンを全ての国(特にロタウイルスによる死のほとんどが発生するアフリカやアジアの低所得ないし中所得国)に導入させるため、PATH、WHO、アメリカ疾病予防管理センターおよびGAVIアライアンスは研究機関や政府と協力し、普及活動に努めている。
疫学
A群ロタウイルスはヒトのロタウイルス性胃腸炎の原因の90%を占め、世界的に常在している。発展途上国では1年間にロタウイルスが数百万件の下痢症を引き起こしており、このうちのほぼ200万件の患者が入院する。2013年には5歳未満の幼児、215,000人がロタウイルスにより死亡しており、その90%は発展途上国における死である。5歳までにほぼ全ての幼児がロタウイルスに感染する。ロタウイルスは乳幼児の重篤な下痢の主因であり、入院の原因の3分の1を占め、5歳未満の乳幼児において下痢に起因する死の37%、全死因の5%をそれぞれ占める。男児は女児に比べ、ロタウイルスにより入院する事が多いようである。ロタウイルスの感染は主に冷涼で乾燥した季節に発生する。汚染食料に起因する感染事例数は定かでない。
A群ロタウイルスによる下痢症は病院にいる乳児、デイケアセンターを利用する幼児、老人ホームに住む高齢者等の間で流行する。また、コロラドでは1981年に汚染された水道水が原因になって流行したこともある。2005年にはニカラグアで記録に残る上では最大級の流行が発生した。この前例のない大規模な流行はA群ロタウイルスのゲノムに生じた変異と関連しており、ウイルスは変異を起こす事で住民の間で共有されていた免疫を回避する事ができた可能性がある。同等の大流行は1977年にブラジルでも発生している。
成人下痢症ウイルス(ADRV株)とも呼ばれるB群ロタウイルスは中国で感染者が全世代に渡る、数千人規模の大流行を起こしてきた。この一連の流行は飲料用の水が下水によって汚染されたために発生している。1998年にはインドでもB群ロタウイルス感染症が発生しており、病原ウイルスの株名がCAL株と命名された。流行を起こしてきたADRV株と異なり、CAL株は常在性であるようである。これまでのB群ロタウイルスの流行は特定の地域に限局にしており、例えばアメリカ人はB群ロタウイルスに対して免疫を持たないことが血清調査から示されている。
C群ロタウイルスは散発的に小児の下痢を引き起こしており、小規模の流行が家庭内で生じた事もある。
動物のロタウイルス感染
ロタウイルスは多くの種の動物の幼齢個体に感染し、野生動物にとっても飼育動物にとってもロタウイルスは世界的に下痢の主要な病原体である。仔牛や仔豚をはじめとした家畜の病原体として、高い罹患率と致死率を持つロタウイルスは治療に係る経費によって農場経営者に対し経済的損失を生じさせる。また、動物のロタウイルスはヒトのロタウイルスと遺伝子を交換することができる。動物のロタウイルスがヒトに感染することがあり、これは直接動物のウイルスがヒトに感染する場合と、動物のロタウイルスのRNA分節の一部が遺伝子再集合を経てヒトの株に取り込まれる場合とがある。
歴史
1943年、ジェイコブ・ライトとホレイス・ホーズは感染性の下痢を発症した小児患者の糞便から得たろ過性病原体が牛にも下痢を引き起こすことを証明した。30年後、保存されていたこの病原体が、ロタウイルスであることが示される。この間にはマウスの下痢症の病原体が家畜の下痢にも関連していることも明らかにされている。また、1973年にはルース・ビショップらによって胃腸炎の小児患者に認められる近縁のウイルスが報告される。
1974年、車輪のようなロタウイルスの形状を電子顕微鏡で観察したトーマス・ヘンリー・フルーウェットが、「ロタウイルス」の種名を提案する。ロタ (rota) はラテン語で車輪を意味する。その4年後、ロタウイルスの命名はInternational Committee on Taxonomy of Virusesによって公式に認可された。1976年には近縁のウイルスが他の動物種から報告される。いずれも急性胃腸炎を引き起こすものであり、世界的にヒトと動物の双方に感染する病原体の集合であると認識された。
ロタウイルスの血清型については、1980年に初めて記され、その翌年にはヒトに由来するロタウイルスの細胞培養法が報告される。この培養法はサル腎臓由来の細胞を、トリプシン(哺乳類の十二指腸に存在する酵素で、現在ではロタウイルスの複製に必要であることが知られる)添加培地で培養するというものであった。ロタウイルスの培養法は研究速度を加速させ、1980年代半ばには最初のワクチン候補株が評価される。
1998年、アメリカ合衆国でロタウイルスワクチンの使用が認可される。アメリカ合衆国、フィンランド及びベネズエラで行われた臨床治験によって、ロタウイルスワクチンはA群ロタウイルスによる重症下痢症の80 - 100 %を予防することが明らかにされ、一方で、統計学的に有意な副作用は検出されなかった。
しかしながら、このワクチンは接種した乳児1万2,000人に1人の割合で、腸重積症のリスクを増大しうることがわかり、製造会社は1999年に市場から製品を回収する。この事件は、ロタウイルスワクチンのリスクと利益をめぐる、激しい議論を引き起こした。
2006年に、A群ロタウイルスに対する2つの新しいワクチンの小児における使用が、安全であり効果的であると証明され、2009年には世界保健機関が、ロタウイルスの感染予防にロタウイルスワクチンを、各国の予防接種プログラムに導入することを推奨している。
脚注
関連項目
- 新興感染症
- レオウイルス科
- 胃腸炎
- ノロウイルス
外部リンク
- ロタウイルス IASR Vol.35 No.3(No.409) March 2014 国立感染症研究所 病原微生物検出情報
- ロタウイルス感染症 愛媛県立衛生環境研究所 愛媛県感染症情報センター
- ロタウイルス関連脳炎・脳症における臨床症状と神経学的後遺症の関連 (PDF) 小児感染免疫第20巻第1号